
尽管鸡尾酒抗逆转录病毒疗法对于防治艾滋病毒已经具有明显效果,但医学界已经将从体内根除病毒作为治疗手段的研究提上日程。一项“激活并杀死”的策略,将帮助感染者把潜伏状态的hiv病毒激活成带有活性的病毒,以便更容易被人类免疫系统及抗病毒药物分子发现并杀死。目前科学研究发现一个新的化合物分子(L-HIPPO)能有效侦察到HIV-1病毒蛋白Pr55,并将其拦截。
L-HIPPO可将萌芽状态的病毒从细胞质转移至等离子膜,使感染病毒被“封闭”继而诱导被感染的宿主细胞凋亡,这种"锁定和凋亡"的操作由新型化合物在 HIV 感染细胞中进行,为根除HIV病毒策略中"激活"和"杀死"步骤之间的差距提供了一种手段。该新型化合物的运用似乎为达到根除体内 HIV 病毒目标提供了一个有希望的步骤。
自1997年以来,虽然HIV病毒/AIDS已在抗逆转录病毒治疗(ART)下得到很好控制, 但迄今为止艾滋病毒仍然无法治愈。在2015年,大约有3670万人感染HIV病毒,110万人死于艾滋病。大多数抗 HIV 药物通过阻断病毒复制周期的关键步骤而起作用,使药物分子有效对抗病毒的主动复制,但对体内细胞库中残留的潜伏病毒作用却不大,潜伏的病毒依然被封闭在体内, 在抗病毒药物的作用下与感染者和平共处。根本性治疗HIV的方法,在于消除具有活性及潜伏的HIV病毒,而目前大多数治疗方法并非能达到根本性治疗的目的。对此,消除体内艾滋病毒的细胞储存库便成了治疗HIV的目标。
此前提出了"踢杀"的策略,将"踢"过程与随后的"杀死"过程连接起来, 通过增强免疫反应或细胞损伤的诱导,让感染HIV病毒的细胞(即含有活性 HIV的细胞)"踢腿",使潜伏HIV表达病毒蛋白。然而,有效"杀死"病毒的方法依然在研究,在此报告一个新的"锁定和凋亡"化合物,遵循"踢"的过程,并促进根除被HIV病毒感染的细胞。
HIV病毒通常能主动识别并进入CD4+T淋巴细胞,并在细胞内完成复制,释放出大量的后代病毒, 进而靶向其他CD4+T淋巴细胞进行不断繁殖。对于抑制新的病毒复制将有助于降低病毒传播性、减轻患者体内的免疫负担。科学家们正在试图合成一个小分子,它会阻碍后代病毒的萌芽,把被HIV病毒感染的细胞变成HIV病毒的"牢房",使被“囚禁”的病毒无法再破坏其他正常的细胞。
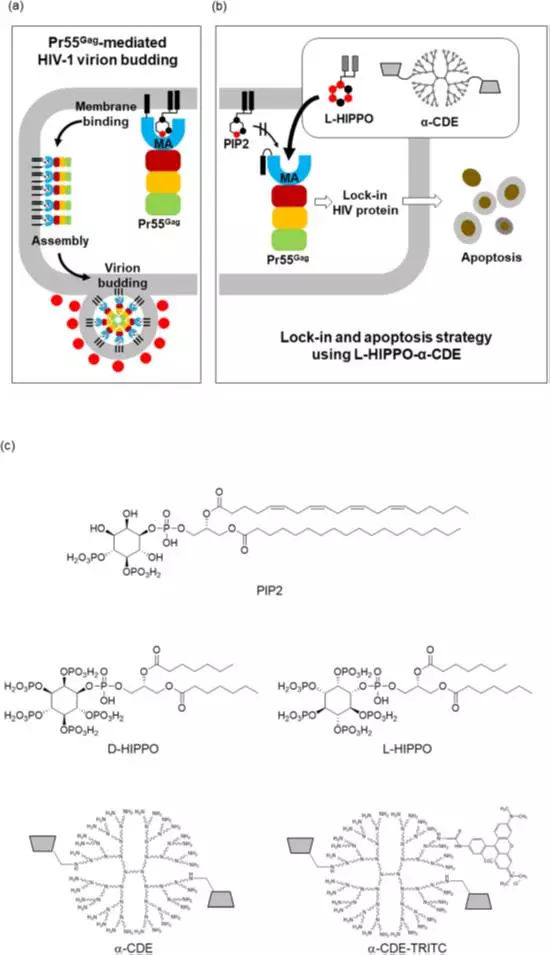
上图展示了一个人造分子(L-HIPPO)促使HIV病毒被锁定和凋亡的策略。
(a)病毒蛋白Pr55Gag标识了HIV病毒的萌芽,被绑定到膜磷脂PIP2。并在膜上组装形成病毒;
(b)α-CDE 将L-HIPPO送到PIP2-Pr55Gag 结合的细胞中, 以干扰病毒的萌芽。HIV-1随宿主细胞凋亡而死亡;
(c)图为PIP2、D-HIPPO、L-HIPPO、α-CDE的结构, 以及与TRITC (α--TRITC)结合的α-多粒子分析;
图中的a和b。宿主细胞至死都不释放病毒。
因此,如果所有的病毒被踢出,并锁定在宿主细胞内,这些细胞的死亡也标志着艾滋病毒被消灭在体内。
综上所述, 目前已经开发了一种新型的L-HIPPO化合物分子,能有效结合HIV-1病毒蛋白Pr55Gag,使Pr55Gag从细胞质迁移到细胞膜,结合到一个特定的肌醇磷脂PIP2膜上,抑制病毒释放,并诱导宿主细胞的凋亡,在这项研究中,L-HIPPO对细胞没有毒性。宿主细胞凋亡对周围细胞的影响、释放可溶性因子如细胞因子等,已被广泛研究和揭示,其调控是可能的,在细胞凋亡中能观察到旁观者效应,但这种方法可以改善细胞凋亡,而不影响其他正常细胞。
各种研究已表明目前的“踢出和杀死" 策略非常可行, 只是目前满足"杀死"病毒条件的药物还在继续研发中。就目前的研究来看, 已经有一种替代方法来终止细胞持续被病毒感染的命运,不一定是"杀死"病毒,而是让病毒在封闭的细胞中"自杀(凋亡)"。对于未来包含L-HIPPO化合物分子的口服药物,其前景是可以想象的。这项研究中提出通过"锁定和凋亡"的方法来抑制病毒的释放,并诱导细胞凋亡成为根除HIV病毒的基础。这种 "锁定和凋亡"治疗方法也将为各种抵抗病毒的策略铺平道路。
【参考文献】
1.Marsden,M.D.&Zack,J.A.HIV/AIDAeradication. Bioorganic & medicinal chemistryletters 23,4003–4010(2013).
2. UNAIDS | 2016.AIDS by the numbers - AIDSis not over, but it can be. a pdffilehttp://www.unaids.org/sites/default/files/media_asset/AIDS-by-the-numbers-2016_en.pdf(2016).
3. Churchill, M.J., Deeks, S. G., Margolis,D. M., Siliciano, R. F. & Swanstrom, R. HIVreservoirs: what, where and howto target them. Nature Reviews Microbiology 14,55–60 (2016).
4. Cillo, A. R.& Mellors, J. W. Whichtherapeutic strategy will achieve a cure for HIV-1?Current opinion in virology18, 14–19 (2016).
5. Kimata, J. T.,Rice, A. P. & Wang, J.Challenges and strategies for the eradication of theHIV resernoir. CurrentOpinion in Imunology 42, 65–70 (2016).
6. Ono, A., Ablan,S. D., Lockett, S. J.,Nagashima, K. & Freed, E. O. Phosphatidylinositol(4,5) bisphosphate regulatesHIV-1 Gag targeting to the plasma membrane.Proceedings of the National Academyof Sciences of the United States of America101, 14889–14894 (2004).
7. Saad, J. S. etal. Structural basis fortargeting HIV-1 Gag proteins to the plasma membranefor virus assembly.Proceedings of the National Academy of Sciences of the UnitedStates of America103, 11364–11369 (2006).
8. Charlier, L. etal. Coarse-grainedsimulations of the HIV-1 matrix protein anchoring:revisiting its assembly onmembrane domains. Biophysical Journal 106, 577–585(2014).
9. Mercredi, P. Y.et al. Structural andmolecular determinants of membrane binding by the HIV-1matrix protein. Journalof Molecular Biology 428, 1637–1655 (2016).
10. Anraku, K. etal. Highly sensitiveanalysis of the interaction between HIV-1 Gag andphosphoinositide derivativesbased on surface plasmon resonance. Biochemistry49, 5109–5116 (2010).
11. Tateishi, H. etal. Design and synthesisof lipid-coupled inositol 1,2,3,4,5,6-hexakisphosphatederivatives exhibitinghigh-affinity binding for the HIV-1 MA domain. Organic& biomolecularchemistry 12, 5006–5022 (2014).
12. Chukkapalli,V., Hogue, I. B., Boyko,V., Hu, W. S. & Ono, A. Interaction between thehuman immunodeficiency virustype 1 Gag matrix domain andphosphatidylinositoL-(4,5)-bisphosphate isessential for efficient gag membranebinding. Journal of virology 82, 2405–2417(2008).
13. Adachi, A. etal. Production of acquiredimmunodeficiency syndrome-associated retrovirus inhuman and nonhuman cellstransfected with an infectious molecular clone.Journal of virology 59, 284–291(1986).
14. Ozaki, S.,DeWald, D. B., Shope, J. C.,Chen, J. & Prestwich, G. D. Intracellulardelivery of phosphoinositides andinositol phosphates using polyamine carriers.Proceeding of the National Academyof Sciences of the United States of America 97,11286–11291 (2000).
15. Arima, H.,Motoyama, K. & Higashi,T. Sugar-appended polyamidoamine dendrimerconjugates with cyclodextrins ascelL-specific non-viral vectors. Advanced drugdelivery reviews 65, 1204–1214(2013).
16. Arima, H.,Hayashi, Y., Higashi, T.& Motoyama, K. Recent advances in cyclodextrindelivery techniques. Expertopinion on drug delivery 12, 1425–1441 (2015).
17. Kihara, F.,Arima, H., Tsutsumi, T.,Hirayama, F. & Uekama, K. In vitro and in vivogene transfer by an optimizedalpha-cyclodextrin conjugate with polyamidoaminedendrimer. Bioconjugatechemistry 14, 342–350 (2003).
18. Arima, H. etal. Enhancement of genetransfer activity mediated by mannosylateddendrimer/alpha-cyclodextrinconjugate (generation 3, G3). Journal of controlledrelease: official journal ofthe Controlled Release Society 116, 64–74 (2006).
19. Arima, H.,Kihara, F., Hirayama, F.& Uekama, K. Enhancement of gene expression bypolyamidoamine dendrimerconjugates with alpha-, beta-, and gamma-cyclodextrins.Bioconjugate chemistry12, 476–484 (2001).
20. Arima, H. etal. Inhibitory effect ofsiRNA complexes with polyamidoaminedendrimer/alpha-cyclodextrin conjugate(generation 3, G3) on endogenous geneexpression. European journal of pharmaceuticalsciences: official journal ofthe European Federation for PharmaceuticalSciences 44, 375–384 (2011).
21. Ono, A. &Freed, E. O. Plasmamembrane rafts play a critical role in HIV-1 assembly andrelease. Proceeding ofthe National Academy of Sciences of the United States ofAmerica 98, 13925–13930(2001).
22. Duarte, S.,Carle, G., Faneca, H., deLima, M. C. P. & Pierrefite-Carle, V. Suicidegene therapy in cancer: Wheredo we stand now? Cancer Letters 324, 160–170(2012).
23. Poon, I. K. H.,Lucas, C. D., Rossi, A.G. & Ravichandran, K. S. Apoptotic cell clearance:basic biology andtherapeutic potential. Nature Reviews Immunology 14, 166–180(2014).
24. Monde, K.,Contreras-Galindo, R.,Kaplan, M. H., Markovitz, D. M. & Ono, A. Humanendogenous retrovirus K Gagcoassembles with HIV-1 Gag and reduces the releaseefficiency and infectivity ofHIV-1. Journal of virology 86, 11194–11208(2012).
25. Fujita, M. etal. Expression of HIV-1accessory protein Vif is controlled uniquely to be lowand optimal by proteasomedegradation. Microbes and infection/Institut Pasteur6, 791–798 (2004).
26. Fouchier, R.A., Meyer, B. E., Simon, J.H., Fischer, U. & Malim, M. H. HIV-1 infectionof non-dividing cells:evidence that the amino-terminal basic region of theviral matrix protein isimportant for Gag processing but not for post-entrynuclear import. The EMBOjournal 16, 4531–4539 (1997).
27. Simon, J. H. etal. The Vif and Gagproteins of human immunodeficiency virus type 1 colocalizein infected human Tcells. Journal of virology 71, 5259–5267 (1997).
28. Anraku, K. etal. Design and synthesisof biotinylated inositol phosphates relevant to thebiotin-avidin techniques.Organic & biomolecular chemistry 6, 1822–1830(2008).
29.Karabacak,M.etal.Synthesis andEvaluation of New Pyrazoline Derivatives as PotentialAnticancer Agents.Molecules (Basel, Switzerland) 20, 19066–19084 (2015).





